I geni che saltano
22 dicembre 2001
Nel 1951, la genetista
Barbara Mc Clintock, per spiegare i modelli genetici dei cereali,
introdusse il termine di "elementi controllori", ma
molti genetisti tardarono a comprendere l'importanza della scoperta,
grazie alla quale nel 1983, alla stessa Mc Clintock, venne assegnato
il Premio Nobel. Oggi gli scienziati, a distanza di cinquant'anni,
sono in grado di realizzare una "fotografia" di uno
di questi elementi proprio nell'istante in cui si trova in azione,
in altre parole è possibile osservare i geni mentre "saltano"
da una zona all'altra del DNA. Come spesso avviene nel mondo
della ricerca, alcuni modelli di spiegazione necessitano a volte
di tempi piuttosto lunghi prima di ottenere il consenso da parte
della comunità scientifica, e l'uso di mezzi tecnologici
più sofisticati può contribuire alla verifica
delle ipotesi che vengono proposte come schema di riferimento.
Parlare di DNA significa scendere nel mondo dell'infinitamente
piccolo in cui gli ordini di grandezza vanno dal millesimo di
millimetro (micron) al decimilionesimo di millimetro (angstrom).
Il lavoro compiuto dai ricercatori del Dipartimento di Biochimica
della Wisconsin University a Madison, ha utilizzato la tecnica
della cristallografia a raggi X. La rivista Science, nel mese
di Luglio, dedica la copertina ad un'immagine raffigurante la
struttura tridimensionale di un enzima che permette ad un elemento
genetico trasponibile di saltare da una parte all'altra del
DNA. La visione del DNA come quella di una struttura statica
in grado semplicemente di fornire informazioni per la sintesi
proteica, lascia adesso il posto ad un modello dinamico che
riesce a spiegare l'enorme possibilità di adattamento
ed evoluzione del genoma, come per esempio nel caso di quello
umano che secondo alcune stime è formato almeno da un
30% di elementi trasponibili chiamati trasposoni. "Gli
elementi trasponibili hanno la potenzialità di rimodellare
il genoma e di facilitare il movimento dell'informazione genetica,
come la resistenza antibiotica," dice Bill Reznikoff, genetista
molecolare. La struttura di questo complesso proteina-DNA mostrata
nella copertina della rivista, descrive la struttura tridimensionale
dell'enzima trasposasi Tn5 dell'Escherichia Coli diretto verso
il trasposone Tn5. "E' un importante passo verso la comprensione
delle basi strutturali della trasposizione," dice Rayment,
cristallografo e biologo molecolare e principale co-autore dello
scritto. Nel passato, gli studi della struttura degli enzimi
che innescano la trasposizione si sono concentrati sul centro
attivo che taglia l'elemento del DNA, dice Rayment. Non si sapeva
come l'intero enzima si legasse o interagisse con il DNA, e
la rappresentazione della struttura tridimensionale del complesso
proteina-DNA fornisce ora una visione molto più chiara
delle interazioni a livello molecolare tra l'enzima ed il DNA.
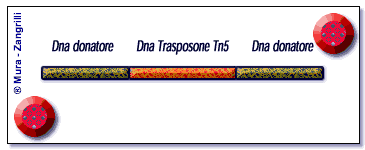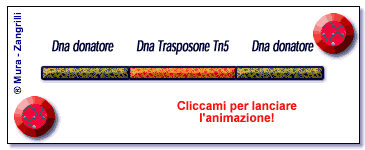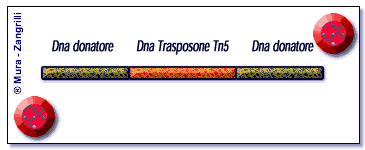 Lo schema illustra il meccanismo della trasposizione catalizzato
dal Tn5 trasposasi. Inizialmente singole molecole di trasposasi
(in rosso) si legano a siti specifici posti alle terminazioni
del DNA trasposone (in arancio). Successivamente, si forma un
anello di DNA trasposone in un complesso sinaptico che porta
le due terminazioni del trasposone ad unirsi insieme. A questo
punto, formato il complesso sinaptico, il Tn5 trasposasi stacca
il DNA trasposone dal DNA "donatore" (in verde). Ora
il complesso Tn5 trasposasi/DNA è libero di muoversi
fino ad incontrare e legarsi al DNA "bersaglio" (in
verde scuro). Il processo di trasposizione chiamato "trasferimento
del filamento" è completo, l'enzima Tn5 ha catalizzato
l'inserzione di un DNA trasposone in una nuova locazione di
DNA. Tra gli altri coautori dello scritto, tutti del Dipartimento
di Biochimica nel College di Agronomia e Scienze Naturali, troviamo
Douglas Davies e Igor Goryshin. Davies insieme con Rayment,
ha sviluppato i cristalli di enzimi-DNA per analizzarli usando
la cristallografia a raggi X. Goryshin, un biologo molecolare,
lavorava con Reznikoff nello sviluppo, isolamento e purificazione
del trasposasi. Le scoperte del team hanno implicazioni per
le ricerche sull'AIDS perché il virus-1 dell'immunodeficienza
umana (HIV-1), per inserirsi nel DNA, usa un processo simile
alla trasposizione. "Proprio come gli enzimi chiamati trasposasi
rendono la trasposizione possibile, enzimi chiamati integrasi
catalizzano eventi simili nei retrovirus, compreso l'HIV-1,"
dice Rayment. "I ricercatori adesso hanno studiato il nucleo
catalitico di cinque differenti trasposasi ed integrasi, e questi
mostrano una somiglianza notevole. Di conseguenza, un'immagine
chiara di uno di essi fornisce una migliore comprensione di
tutti quelli simili." Per controllare l'AIDS, i ricercatori
dell'industria farmaceutica stanno selezionando composti in
grado di inibire l'HIV-1 integrasi, in accordo con Rayment e
Reznikoff.
Lo schema illustra il meccanismo della trasposizione catalizzato
dal Tn5 trasposasi. Inizialmente singole molecole di trasposasi
(in rosso) si legano a siti specifici posti alle terminazioni
del DNA trasposone (in arancio). Successivamente, si forma un
anello di DNA trasposone in un complesso sinaptico che porta
le due terminazioni del trasposone ad unirsi insieme. A questo
punto, formato il complesso sinaptico, il Tn5 trasposasi stacca
il DNA trasposone dal DNA "donatore" (in verde). Ora
il complesso Tn5 trasposasi/DNA è libero di muoversi
fino ad incontrare e legarsi al DNA "bersaglio" (in
verde scuro). Il processo di trasposizione chiamato "trasferimento
del filamento" è completo, l'enzima Tn5 ha catalizzato
l'inserzione di un DNA trasposone in una nuova locazione di
DNA. Tra gli altri coautori dello scritto, tutti del Dipartimento
di Biochimica nel College di Agronomia e Scienze Naturali, troviamo
Douglas Davies e Igor Goryshin. Davies insieme con Rayment,
ha sviluppato i cristalli di enzimi-DNA per analizzarli usando
la cristallografia a raggi X. Goryshin, un biologo molecolare,
lavorava con Reznikoff nello sviluppo, isolamento e purificazione
del trasposasi. Le scoperte del team hanno implicazioni per
le ricerche sull'AIDS perché il virus-1 dell'immunodeficienza
umana (HIV-1), per inserirsi nel DNA, usa un processo simile
alla trasposizione. "Proprio come gli enzimi chiamati trasposasi
rendono la trasposizione possibile, enzimi chiamati integrasi
catalizzano eventi simili nei retrovirus, compreso l'HIV-1,"
dice Rayment. "I ricercatori adesso hanno studiato il nucleo
catalitico di cinque differenti trasposasi ed integrasi, e questi
mostrano una somiglianza notevole. Di conseguenza, un'immagine
chiara di uno di essi fornisce una migliore comprensione di
tutti quelli simili." Per controllare l'AIDS, i ricercatori
dell'industria farmaceutica stanno selezionando composti in
grado di inibire l'HIV-1 integrasi, in accordo con Rayment e
Reznikoff.
© Alessandro Mura

